Enzimas formam tesoura molecular que destrói PET
Redação do Site Inovação Tecnológica - 16/04/2019
[Imagem: Martin Künsting/HZB]
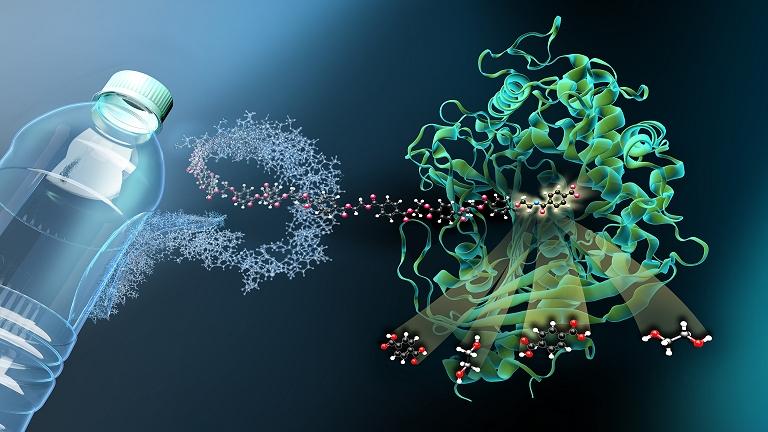
Enzimas que comem PET
Em 2016, um grupo de pesquisadores japoneses descobriu uma bactéria que cresce no PET (polietileno tereftalato), o material das garrafas de refrigerante, e se alimenta parcialmente do polímero tão difícil de degradar.
Eles descobriram que a bactéria Ideonella sakaiensis possui duas enzimas especiais, PETase e MHETase. A PETase decompõe o plástico em blocos de construção de PET menores, principalmente o MHET, e a MHETase divide esse MHET em dois blocos precursores básicos do PET, o ácido tereftálico e o etilenoglicol.
Ambos os componentes são muito valiosos para sintetizar PET novo sem a adição de petróleo - para um ciclo de produção e recuperação sustentável e fechado.
PETase e MHETase
Para desfrutar de todo o potencial dessa dupla, porém, é necessário desvendar a estrutura tridimensional das duas enzimas, permitindo a construção de versões sintéticas otimizadas, que não atendam apenas às necessidades das bactérias, mas à necessidade de lidar com imensos volume de lixo.
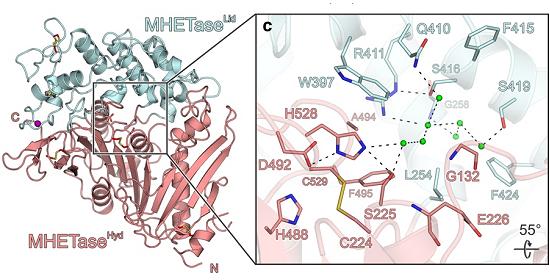
Em abril de 2018, a estrutura da PETase foi finalmente resolvida de forma independente por vários grupos de pesquisa. Agora, Gottfried Palm e colegas da Universidade Greifswald, na Alemanha, desvendaram a estrutura da MHETase.
"A MHETase é consideravelmente maior que a PETase e ainda mais complexa. Uma única molécula de MHETase consiste em 600 aminoácidos, ou cerca de 4.000 átomos. A MHETase tem uma superfície que é aproximadamente duas vezes maior do que a superfície da PETase e tem, portanto, um potencial consideravelmente maior de otimização para a decomposição do PET," disse o professor Gert Weber.
Decifrar a estrutura permitiu que os pesquisadores vissem exatamente onde a molécula MHET, produzida pela PETase, se liga à MHETase, onde é quebrada em seus dois componentes formadores.
Com isto, foi possível produzir uma variante MHETase com atividade otimizada, a fim de utilizá-la, juntamente com a PETase, para uma reciclagem sustentável do PET. Os resultados foram tão promissores que a equipe chamou o composto de "tesoura molecular para cortar PET".
[Imagem: Palm et al. - 10.1038/s41467-019-09326-3]
Ciclo biotecnológico
Foi um primeiro passo, mas otimizações adicionais serão necessárias porque nem a PETase e nem a MHETase são particularmente eficientes do ponto de vista de uma reciclagem em escala industrial.
A equipe planeja complementar esses estudos de otimização com trabalhos sobre estruturas biológicas, a fim de desenvolver sistematicamente enzimas de digestão de plástico para aplicações ambientais.
Produzir esses tipos de enzimas em ciclos biotecnológicos fechados, por exemplo, pode ser uma maneira de quebrar os plásticos PET e outros polímeros em seus blocos básicos. Esta também seria a chave para uma solução de longo prazo para a reciclagem dos resíduos plásticos: A produção de plástico seria um ciclo fechado e não mais dependente do petróleo.
Artigo: Structure of the plastic-degrading Ideonella sakaiensis MHETase bound to a substrate
Autores: Gottfried J. Palm, Lukas Reisky, Dominique Böttcher, Henrik Müller, Emil A. P. Michels, Miriam C. Walczak, Leona Berndt, Manfred S. Weiss, Uwe T. Bornscheuer, Gert Weber
Revista: Nature Communications
Vol.: 10, Article number: 1717
DOI: 10.1038/s41467-019-09326-3


Material supera diamante na condução de calor
Descoberta liga magnetismo e eletricidade para tecnologias mais rápidas
Termodinâmica da luz leva tecnologias ópticas a um novo patamar
Theia, o planeta que formou a Lua, era vizinho do Sol
Experimento da dupla fenda com som mostra diferenças em relação à luz
Núcleo da Terra é sólido ou líquido? Nenhum deles, é superiônico
Laser de amendoim coloca luz a serviço da medicina e da saúde
Sistema Solar é três vezes mais rápido, contestando teoria cosmológica
Gerador transforma vibrações de qualquer frequência em energia
"Metal vivo" pode unificar biologia e eletrônica
Finalmente: Criada técnica de reciclagem química do PET
Agricultura flutuante: Plataformas artificiais economizam terra e tratam a água
É plástico de papel ou papel plástico? É brasileiro
Mouse de madeira mostra que eletrônica pode ser verde e biodegradável
Este plástico irá desaparecer em 13 meses
Sargaço melhora cerâmicas para construção civil
Todos os direitos reservados.
É proibida a reprodução total ou parcial, por qualquer meio, sem prévia autorização por escrito.