Pesos atômicos variáveis alteram Tabela Periódica
Com informações da New Scientist - 29/05/2013
[Imagem: IUPAC]
Você já deve ter ouvido falar, ou talvez lido em seus livros de química, que os "pesos atômicos são constantes imutáveis da natureza".
Nada poderia estar mais longe da verdade.
Na realidade, o peso atômico de alguns elementos varia dependendo de onde você está na Terra.
Prótons e nêutrons
A maior parte da massa de um átomo reside no seu núcleo, composto de prótons e nêutrons (com a exceção do hidrogênio, cujo núcleo é constituído por um único próton).
O número de prótons no núcleo determina com qual átomo você está lidando: todos os átomos de carbono têm 6 prótons, todos os átomos de oxigênio têm 8, e assim por diante.
Mas o número de nêutrons pode variar entre átomos do mesmo elemento - átomos do mesmo elemento, mas com diferentes números de nêutrons, são chamados isótopos.
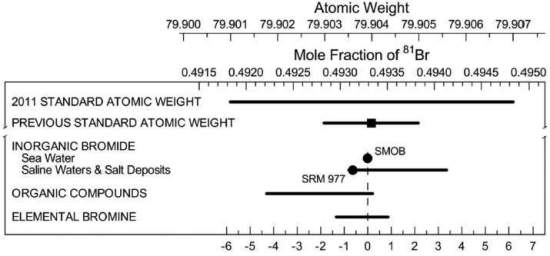
Agora, os guardiões da Tabela Periódica - a União Internacional de Química Pura e Aplicada (IUPAC) - decidiram que os pesos atômicos do bromo e do magnésio não serão mais representados por um número, mas por um intervalo.
O peso atômico do bromo mudou de 79,904 para o intervalo [79,901 a 79,907].
O peso atômico do magnésio, por sua vez, antigamente era 24,3050 - agora ele é representado pelo intervalo [24,304 a 24,307].
Pode parecer pouco, mas é uma mudança radical em relação a visões tradicionais do tipo "constante imutável da natureza".
Números atômicos variáveis
E por quê essa mudança?
Todos os elementos têm um certo número de isótopos instáveis, que se "quebram" através de um processo chamado decaimento radioativo. Mas alguns elementos têm também mais do que um isótopo estável.
É aí que os químicos começam a ter problemas quando querem definir o peso atômico.
O bromo, por exemplo, tem dois isótopos estáveis que ocorrem na Terra em quantidades semelhantes. Mas os dois não estão igualmente dispersos: por exemplo, o isótopo mais pesado do bromo é ligeiramente mais comum na água do mar e nos sais do que nas substâncias orgânicas.
O magnésio se comporta de forma semelhante: existem três isótopos estáveis deste metal, e eles variam ligeiramente em abundância em diferentes ambientes.
Isto significa que o peso médio de um átomo de bromo ou de magnésio nestes diferentes ambientes também varia.
Daí a necessidade da mudança - dependendo da situação onde a medição for feita, resultados diferentes poderão estar igualmente corretos.
E, já que estavam com a mão na massa, os químicos da IUPAC aproveitaram a oportunidade para ajustar os pesos atômicos de mais três elementos: germânio, índio e mercúrio.
Versões periódicas
E não espere que a Tabela Periódica fique estável por muito tempo.
Foram necessários 150 anos para que as propriedades dos elementos químicos sofressem a primeira modificação - a Tabela Periódica foi corrigida pela primeira vez na história em 2010.
Agora, menos de três anos depois, já veio a segunda modificação.
Ou seja, talvez seja uma boa ideia olhar a "versão da Tabela Periódica" da próxima vez que você precisar consultar uma.
Artigo: Atomic weights of the elements 2011
Autores: Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska1, Ronny Schoenberg, Glenda O Connor, Thomas Walczyk, Shige Yoneda, Xiang-Kun Zhu
Revista: Pure and Applied Chemistry
Vol.: 85, No. 5, pp. 1047-1078
DOI: 10.1351/PAC-REP-13-03-02


Metassuperfície de grafeno liga e desliga ondas eletromagnéticas
Folha artificial refresca verão e aquece inverno sem gastar eletricidade
Material supera diamante na condução de calor
Descoberta liga magnetismo e eletricidade para tecnologias mais rápidas
Duas hélices girando ao contrário tornam navios mais eficientes
Termodinâmica da luz leva tecnologias ópticas a um novo patamar
Seres humanos evoluíram para a natureza, não para as cidades
Theia, o planeta que formou a Lua, era vizinho do Sol
Laser de amendoim coloca luz a serviço da medicina e da saúde
Núcleo da Terra é sólido ou líquido? Nenhum deles, é superiônico
Ler as horas em um relógio quântico gasta mais energia que fazê-lo funcionar
Miniaturização da Metrologia quer um INMETRO dentro de um chip
Relógio com tique-taque aleatório pode unificar a física e desvendar a biologia
Cientistas driblam princípio da incerteza de Heisenberg e medem tudo com precisão
Supremacia quântica física: 20 milhões de anos de medições em 20 segundos
Todas as unidades da eletricidade são medidas juntas pela primeira vez
Todos os direitos reservados.
É proibida a reprodução total ou parcial, por qualquer meio, sem prévia autorização por escrito.