Novo microscópio vê molécula em movimento com precisão atômica
Mark Shwartz - Stanford University - 17/11/2005
Uma equipe de pesquisadores da Universidade de Stanford, Estados Unidos, construiu o primeiro microscópio sensível o suficiente para acompanhar o movimento em tempo real de uma única proteína até o nível de seus átomos individuais. Em artigo publicado no exemplar de 13 de Novembro da revista Nature, os pesquisadores explicam como o novo instrumento permitiu que eles esclarecessem uma questão que intriga os cientistas há anos: como os genes são copiados do DNA - um processo bioquímico que é essencial à vida.
Em um segundo artigo, publicado no periódico Physical Review Letters, os cientistas apresentam uma descrição detalhada do seu novo equipamento, uma versão avançada da "armadilha óptica", que utiliza luz infravermelha para aprisionar e controlar forças sobre uma proteína funcional, permitindo aos pesquisadores monitorar cada movimento da molécula em tempo real.
"No experimento [relatado na] Nature, nós fizemos a medição mais precisa já feita de uma proteína individual," diz Steven Block, professor de física aplicada e ciências biológicas. "Nós conseguimos medições com precisão de 1 angstrom, ou um décimo de nanômetro. Isto é equivalente ao diâmetro de um único átomo de hidrogênio, e cerca de dez vezes mais preciso do que qualquer medição anterior."
Block é co-autor dos dois artigos, juntamente com três membros de seu laboratório - Elio Abbondanzieri, William Greenleaf e Michael Woodside - além de Joshua Shaevitz e Robert Landick.
Dogma central
No estudo publicado na Nature, Block e seus colegas lidam com um princípio fundamental da biologia, conhecido como seu dogma central, que estabelece que, em organismos vivos, a informação genética flui do DNA para o RNA e daí para as proteínas.
O processo começa com o DNA, a famosa hélice dupla, que armazena as informações genéticas. O DNA é freqüentemente comparado a uma escada em caracol, consistindo de duas fitas conectadas por degraus moleculares chamados "bases", os quais são conhecidos pelas abreviações A, T, G e C.
Uma hélice típica de DNA carrega milhares de genes que codificam milhares de proteínas, responsáveis por manter o organismo vivo e funcionando. Uma única letra mal colocada em uma seqüência de genes no DNA - um G substituído por um T, por exemplo - pode produzir uma proteína defeituosa, que pode causar uma doença séria.
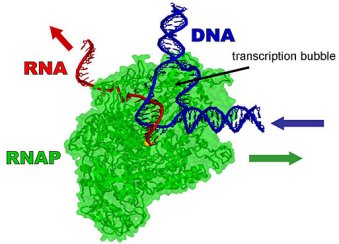
Transcrição
A equipe de pesquisadores centrou sua atenção em um passo crucial no dogma central, um processo conhecido como "transcrição", no qual cada gene é copiado do DNA para o RNA.
A transcrição começa quando uma enzima chamada RNA polimerase (RNAP) trava-se sobre a hélice de DNA e separa uma pequena seção longitudinal. A enzima RNAP então constrói uma nova cadeia de RNA complementar, copiando quimicamente cada base em uma das fitas expostas do DNA. A RNAP continua se movendo para baixo ao longo da hélice de DNA até que os genes tenham sido totalmente copiados.
No experimento relatado na revista Nature, Block e seus colegas utilizaram DNA e RNAP extraídos da bactéria E. coli, que são muito parecidos com a RNAP em organismos mais complexos, incluindo os humanos. "A RNAP é uma das mais importantes enzimas na natureza," diz Block. "Sem ela não haveria messagens RNA, nem proteínas e nem vida."
Lagartas e triturações
Exatamente como a transcrição funciona em nível molecular tem sido objeto de intenso debate entre os cientistas.
"Já se sabe há anos que a RNA é construída uma base de cada vez," diz Block. "Mas isso deixou aberta a questão se a enzima RNA realmente escala a escada DNA um degrau de cada vez, ou se ela se move por blocos - por exemplo, ela adiciona três bases de RNA, salta adiante e então adiciona outras três bases." Esse último processo, chamado prolongamento descontínuo, funciona como a leitura de um livro, explica o cientista: "Quando você lê, você não avança os olhos uma letra por vez. Você movimenta em blocos, lendo palavras inteiras."
Duas hipóteses básicas foram propostas para o prolongamento descontínuo:
O modelo lagarta, no qual a RNAP move-se ao longo do DNA como uma lagarta, com a parte frontal da enzima sempre à frente da parte traseira. E o modelo triturante, segundo o qual a RNAP captura uma volta de DNA, copia cada base dessa volta, e então pega outra volta escada acima.
Determinar qual modelo é correto tem se mostrado um desafio difícil porque, até agora, nenhum instrumento era sensível o suficiente para acompanhar cada passo microscópico dado pela RNAP ao longo do DNA durante a transcrição. As armadilhas ópticas convencionais não são capazes de medir nada menor do que 10 angstroms, ou seja, 1 nanômetro. Entretanto, cada base na hélice de DNA - A, T, G ou C - é separada uma da outra por apenas 3,4 angstroms. "Meu laboratório tem trabalhado arduamente há quase dez anos para quebrar a barreira do nanômetro e atingir uma resolução na faixa dos angstroms," diz Block.
Luz e movimento
Para atingir esse objetivo, a equipe de pesquisadores teve que vencer dois problemas inerentes às pinças ópticas convencionais: a flutuação dos sinais e a dobra das ondas de luz.
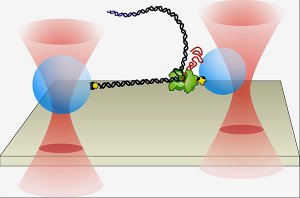
"Quando você envia um laser através do ar, o feixe de luz balança levemente, pela mesma razão que as estrelas piscam no céu," explica Block. "Mas nós queremos usar esse feixe para medir a posição de algo do tamanho de um átomo, então, se o feixe se move apenas 1 angstrom, a medição vai por água abaixo. Nós levamos toda a óptica para o lado de fora do microscópio, fechamo-la em uma caixa selada e substituímos o ar por gás hélio, que possui um índice de refração 10 vezes mais próximo ao vácuo do que o ar. Assim nós conseguimos, grosso modo, 10 vezes menos piscadelas e um instrumento com estabilidade em nível de angstroms.
Além de estabilizar a luz, os pesquisadores também tiveram que melhorar o método para detectar força e deslocamento. Pinças ópticas utilizam minúsculas forças de um feixe de luz infravermelha para aprisionar o DNA e outras moléculas. Em um experimento convencional de pinças ópticas, gotas microscópicas são ligadas próximas às extremidades de uma longa molécula de DNA - um arranjo que lembra o formato de um haltere. Uma única enzima RNAP, ligada à superfície de uma das gotas, move-se então ao longo do DNA e gera uma cadeia complementar de RNA, fazendo com que as extremidades do haltere se aproximem à medida em que ela avança. As duas gotas que formam o haltere são normalmente mantidas próximas ao centro de duas pinças ópticas diferentes. Mas o estudante William Greenleaf descobriu que, se uma das duas gotas no haltere for colocada próxima à fronteira externa de sua armadilha, a força sobre ela se manterá constante, permitindo que medições com resolução de angstroms possam ser feitas de forma rápida e eficiente.
"Isto é exatamente o que você precisa - uma pinça que permite que a RNAP se mova livremente, mas cuja força não se altere," diz Block. "Normalmente a gota está no centro da armadilha, mas exatamente na borda da armadilha nós temos essa propriedade mágica, onde a força é constante."
Ao contrário dos instrumentos convencionais, a nova pinça óptica não exige demorados cálculos computacionais para corrigir forças que interagem entre si. "Esta nova técnica é inteiramente passiva, exatamente como uma garrafa térmica, que apenas fica lá e mantém algo frio," diz Block. "Tudo o que nós temos a fazer é ligar a luz sobre o sistema e tudo o mais cuida de si mesmo. Como resultado, nós finalmente fomos capazes de visualizar os minúsculos passos de 3,4 angstroms que a RNAP da E. coli dá à medida em que transcreve o gene bacteriano."
Resolvendo os debates
Com essa inovação em mãos, o grupo de pesquisadores parece ter resolvido alguns dos argumentos fundamentais sobre a transcrição DNA- RNA. "Muito simples, nosso experimento descarta os dois modelos de descontinuidade," diz Block. "Nem o modelo lagarta nem o modelo triturante são consistentes com nossos dados, e a idéia que alguns mantiveram durante todo o tempo - que a RNAP escala a hélice DNA uma base de cada vez - é provavelmente a resposta correta."
O grupo de pesquisadores também opinou sobre outra controvérsia, relativa ao mecanismo real que permite que a RNAP avance. "A RNAP é um motor molecular que começa em uma extremidade do DNA e caminha até a outra ponta," explica Block. "Ela tira sua energia da reação química que ocorre quando ela copia A, T, G ou C. É como se uma máquina colocada sobre o asfalto pudesse de alguma forma ser alimentada pelo próprio asfalto."
Os cientistas sugeriram dois modelos diferentes para explicar o que alimenta esse motor molecular:
O modelo de expansão, no qual energia armazenada movimenta a enzima para a frente - como uma mola comprimida que é periodicamente liberada. E o modelo de catraca browniana, ou termal, segundo o qual uma energia térmica aleatória faz com que a enzima RNAP se mova para frente e para trás. Cada base do DNA então trava a enzima na posição, de forma que ela não consiga mover-se para trás.
No estudo publicado na revista Nature, Block e seus colegas concluem que o modelo de catraca browniana é provavelmente correta para a RNAP, apesar de se acreditar que vários outros motores de proteínas movam-se com base no modelo de expansão. "Nós estamos fortemente do lado da catraca browniana e contra o modelo de expansão," diz Block. "Mas isto significa que todos os modelos de expansão foram descartados e que todos os modelos de catraca browniana são corretos? Não."
Dobragem molecular
Os pesquisadores também aplicaram a nova tecnologia de pinça óptica a um dos campos mais quentes da pesquisa biomédica - a dobra de moléculas. Para que uma proteína funcione corretamente, ela deve ser dobrada em um formato tridimensional intricado e específico. Doenças como o Mal de Alzheimer, vaca louca e Mal de Parkinson, podem surgir quando proteínas não se dobram na sua conformação 3-D correta. Os pesquisadores médicos estão tentando resolver o mistério de como as proteínas se dobram, na esperança de um dia curar estas e outras doenças.
No experimento publicado na Physical Review Letters, os pesquisadores discutiram alguns aspectos do problema geral da dobragem num enfoque mais geral, concentrando-se em um único grampo de DNA - estruturas dobradas que podem se formar quando uma única fita de DNA se emparelha consigo mesma, ao invés de com a fita oposta. "Grampos de cabelo são modelos maravilhosos." diz Block. "Mantendo a força constante, nós fomos capazes de medir as transições de dobragem e desdobragem de um único grampo de DNA na escala de angstroms. No futuro, isso poderá nos ajudar a entender e prever qual formato uma proteína linear mais complexa irá assumir no espaço tridimensional."
Feito mais importante
O desenvolvimento de um sistema de armadilha óptica ultra-estável, com resolução de angstroms, é um "feito substancial", diz Charles Yanofsky, um dos pioneiros da genética molecular. O novo equipamento é como "adicionar movimento a fotografias no entendimento da ação das enzimas," disse ele.
"Esse feito técnico irá sem dúvida levar a novas informações sobre o mecanismo molecular que sustenta os processos celulares básicos, particularmente esses relacionados à replicação, transcrição e tradução," acrescenta Catherine Lewis, diretora do programa de biofísica do Instituto Nacional de Ciências Médicas.
"Se eu olhar em minha bola de cristal e ver aonde isto irá levar, eu creio que isso escancara o campo da biofísica de moléculas individuais," diz Block. "Nós atingimos uma resolução para uma única molécula comparável ao que um cristalografista tipicamente consegue em um cristal na faixa de milímetros, que possui 1.000 trilhões de moléculas em seu interior. Nós não apenas estamos fazendo isto com uma molécula a uma resolução de 1 angstrom, nós estamos fazendo em tempo real enquanto a molécula está se movendo, a temperatura ambiente e em uma solução aquosa."


Propriedades recordistas do grafeno são encontradas em material 3D
Escultura eletrônica: Componentes têm propriedades ditadas pela geometria
Projetado primeiro detector de grávitons, as partículas da gravidade
Luz é focalizada e desfocada no espaço livre, sem lentes
Calor dá marcha-a-ré, uma descoberta com impactos difíceis de prever
Computador neuromórfico conecta matemática, inteligência e neurociência
Buracos de minhoca não existem, Big Bang é um portal e o tempo vai e vem, propõem físicos
Cristal do tempo levita e desafia Terceira Lei de Newton
Tensão de Hubble surge da física real, e não de erros de medição
Bateria de nióbio inédita é criada na USP
Impressão 3D cria lentes para microscópio de super-resolução
Novo microscópio gera imagens de material invisível
Vencer limitação fundamental da levitação acústica levou a descoberta inesperada
Observada fase exótica da matéria, híbrida entre sólido e líquido
A luz fica inteligente
"Grande Microscópio Unificado" enxerga da microescala até a nanoescala
Todos os direitos reservados.
É proibida a reprodução total ou parcial, por qualquer meio, sem prévia autorização por escrito.



